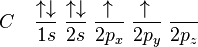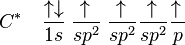Tabela periódica
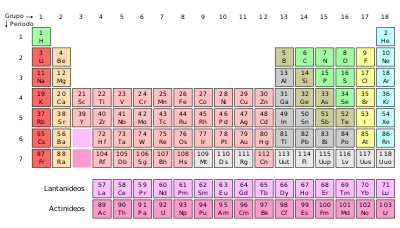
A tabela periódica dos elementos químicos é a disposição sistemática dos elementos, na forma de uma tabela, em função de suas propriedades. É muito útil para se preverem as características e tendências dos átomos. Permite, por exemplo, prever o comportamento de átomos e das moléculas deles formadas, ou entender por que certos átomos são extremamente reativos enquanto outros são praticamente inertes. Permite prever propriedades como eletronegatividade, raio iônico e energia de ionização.
A tabela periódica relaciona os elementos em linhas denominadas períodos e colunas chamadas grupos ou famílias, em ordem crescente de seus números atômicos (Z).
As 18 colunas verticais são denominadas de grupos ou famílias. Os elementos que pertencem a uma mesma família apresentam propriedades semelhantes.
As famílias são designadas pelas letras A e B e denominadas de subgrupo; o grupo é indicado por algarismo romano de I a VIII. Por exemplo, o Sc pertence ao grupo III, subgrupo B, ou simplesmente IIIB, enquanto o Boro pertence ao grupo III, subgrupo A, ou simplesmente IIIA. Recentemente, a American Chemical Society recomendou a substituição dos algarismos romanos por números de 1 a 18, para indicar as famílias da tabela periódica.
Por exemplo: o magnésio pertence a família IIA ou 2; o carbono, à família IVA ou 14.
Algumas famílias recebem denominações especiais:
IA ou 1 = metais alcalinos
IIA ou 2 = metais alcalinoterrosos
VIA ou 16 = calcogênios
VIIA ou 17 = halogênios
VIIIA ou 18 = gases nobres
Períodos
Os elementos de um mesmo período têm o mesmo número de camadas eletrônicas, que corresponde ao número do período. Os elementos conhecidos até o cobre tem sete períodos, denominados conforme a sequência de letras K-Q, ou também de acordo com o número quântico principal- n.
Os períodos:
- (1ª) Camada K - n = 2s
- (2ª) Camada L - n = 8s
- (3ª) Camada M - n = 18s
- (4ª) Camada N - n = 32s
- (5ª) Camada O - n = 32s
- (6ª) Camada P - n = 18s
- (7ª) Camada Q - n = 8s ou 2p
Classificações dos elementos
Dentro da tabela periódica, os elementos químicos também podem ser classificados em conjuntos, chamados de séries químicas, de acordo com sua configuração eletrônica:- Elementos representativos: pertencentes aos grupos 1, 2 e dos grupos de 13 a 17.
- Elementos (ou metais) de transição: pertencentes aos grupos de 3 a 12.
- Elementos (ou metais) de transição interna: pertencentes às séries dos lantanídios e dos actinídios.
- Gases nobres: pertencentes ao grupo 18.
- Metais;
- Semimetais ou metalóides (termo não mais usado pela IUPAC: os elementos desse grupo distribuíram-se entre os metais e os ametais);
- Ametais (ou não-metais);
- Gases nobres;
- Hidrogênio
Elementos naturais: são encontrados na natureza.
Elementos artificiais: são produzidos em laboratórios.
Os elementos artificiais são classificados em:
– cisurânicos: apresentam número atômico abaixo do urânio (Z = 92). Apenas dois:
o tecnécio (Z = 43) e o promécio (Z = 61).
– transurânicos: apresentam número atômico acima do urânio (Z = 92). O urânio é o último elemento natural, portanto todos os elementos com número atômico acima do urânio são artificiais.
Os elementos, na tabela periódica, também podem ser classificados como:
– metais: correspondem a 80% dos elementos conhecidos. São bons condutores de calor e eletricidade e sua condutividade elétrica diminui com o aumento da temperatura; são dúcteis e maleáveis; sólidos à temperatura ambiente, com exceção do mercúrio que é líquido.
– não-metais (ametais): com poucas exceções, esse elementos não conduzem corrente elétrica ou calor (são isolantes). Encontram-se nos estados físicos sólido, líquido e gasoso, em condições ambientes.
– não-metais (ametais): com poucas exceções, esse elementos não conduzem corrente elétrica ou calor (são isolantes). Encontram-se nos estados físicos sólido, líquido e gasoso, em condições ambientes.
A. Distribuição Eletrônica na Tabela Periódica
A.1. Períodos
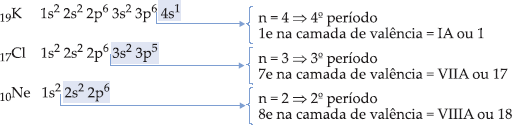
Os elementos que pertencem ao mesmo período apresentam o mesmo número de camadas eletrônicas. Portanto, todos os elementos de um dado período têm em comum a camada de valência, e o número quântico principal desta camada é igual ao número do período.
Assim:
– elementos do 1º período possuem 1 nível de energia ocupado por elétrons.
– elementos do 2º período possuem 2 níveis de energia ocupados por elétrons.
– elementos do 7º período possuem 7 níveis de energia ocupados por elétrons.
Exemplo
O Na se encontra no 3º período, pois possui 3 níveis ocupados por e–, e número quântico principal, n = 3, para a camada de valência.
A.2. Famílias
Os elementos pertencentes a uma mesma família apresentam propriedades químicas semelhantes, pelo fato de possuírem o mesmo número de elétrons na camada de valência.
Exemplos
Para a família A, o número da família, em algarismo romano, indica o número de elétrons na camada de valência.
Por exemplo: IA = 1e– na camada de valência
IIA = 2 e– na camada de valência.
A exceção fica com 2He = 1s2, que pertence à família VIIIA.
Também pode ser utilizada a numeração das famílias 1, 2 e de 13 a 18, onde a encontramos:
Família 1 = 1 e– na camada de valência
Família 2 = 2 e– na camada de valência
A partir da família 13, subtrair 10 do número do grupo para encontrar o número de elétrons de valência. Por exemplo:
Família 13 = 13 – 10 = 3 e– na camada de valência.
A.3. Distribuição Eletrônica
ÁTOMOS NEUTROS
Os elementos de uma mesma família apresentam diferentes graus de semelhança em suas propriedades químicas. Na família A, a variação de tais propriedades é mais regular, o que confere a esses elementos o nome de representativos. Neles, o elétron mais energético encontra-se num subnível s (IA e IIA) ou p (IIIA a VIIIA).
Obs. – O Hélio possui número atômico z = 2, portanto encontramos:
– O elétron de maior energia encontra-se na camada de valência, para os elementos representativos. Portanto, podemos fazer a seguinte relação:
Resumindo temos:

ÍONS
A distribuição eletrônica de íons é semelhante à dos átomos neutros. Lembrando que um íon é formado a partir da perda ou ganho de elétrons que ocorre com um átomo e que os elétrons serão retirados ou recebidos sempre da última camada eletrônica (mais externa), chamada camada de valência, e não do subnível mais energético, teremos, por exemplo, as seguintes distribuições:
11Na: 1s2 2s2 2p6 3s1
 perde 1e da camada de valência
perde 1e da camada de valência
11Na+: 1s2 2s2 2p6
26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
 perde 2e da camada de valência
perde 2e da camada de valência
26Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
Para a distribuição do íon Fe3+, é necessária a retirada de um elétron do subnível d.
26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5
17Cl: 1s2 2s2 2p6 3s2 3p5
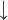 ganha 1e na camada de valência
ganha 1e na camada de valência
17Cl–: 1s2 2s2 2p6 3s2 3p6
Resumindo temos:
Na distribuição eletrônica de íons, a retirada ou o recebimento de elétrons ocorrem na camada de valência e não no subnível de maior energia.
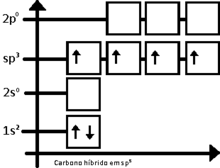
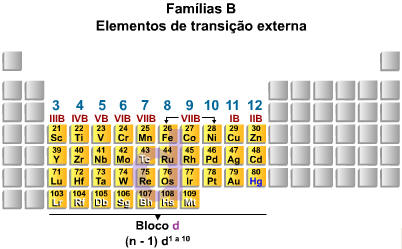
A.4. Elementos de Transição
Os elementos de transição, no centro da tabela periódica (IIIB até IIB, ou 3 a 12) possuem como subnível de maior energia o subnível d, que se encontra na penúltima camada. Portanto, os metais de transição preenchem subníveis nos quais o número quântico principal é uma unidade menor que o número do período. Afora algumas exceções, podemos considerar que os elementos de transição apresentam 2 elétrons na camada de valência e podem ser representados da seguinte maneira:
Exemplificando, podemos dizer que o 21Sc encontra-se no 4º período, cuja camada de valência é 4s2, e possui subnível de maior energia, 3d.
Para localizarmos o número da família, utilizando a distribuição eletrônica, basta somar o número de elétrons que se encontram no subnível de maior energia com o número de elétrons da camada de valência.
Por exemplo:
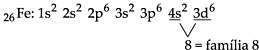
Obs. – Alguns metais de transição, não seguem a distribuição eletrônica de Linus Pauling, dentre os quais destacamos:
Família 6 ou VIB
Crômio e Molibidênio
Família 11 ou IB
Cobre, Prata e Ouro
Resumindo temos:
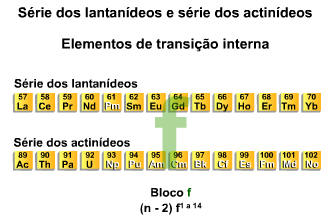
A.5. Elementos de Transição Interna
São os elementos pertencentes à série dos lantanídeos (6º período) e actnídeos (7º período) e que apresentam subnível mais energético o subnível f. São considerados pertencentes à família IIIB ou 3 e estão indicados em linhas fora e abaixo da tabela periódica.
O subnível f, de maior energia, encontra-se na antepenúltima camada e apresenta 2 elétrons na camada de valência. A representação do preenchimento eletrônico para os elementos de transição interna fica.
Exemplo

Resumindo temos:
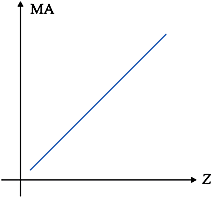
B.1. Propriedades Aperiódicas
São propriedades que têm seus valores só aumentando ou só diminuindo quando colocadas em função do número atômico crescente.
São poucas as propriedades aperiódicas e, dentre elas, temos, por exemplo:
– a massa atômica, que aumenta com o aumento do número atômico.
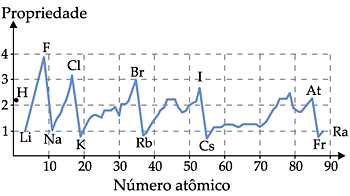
São aquelas que apresentam variação periódica na tabela, crescendo e decrescendo, à medida que o Z aumenta.
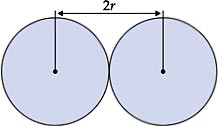
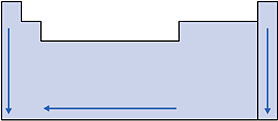
I. Raio Atômico
É muito difícil medir o raio de um átomo isolado, pois a eletrosfera não apresenta um limite bem definido. Mas, quando átomos de um elemento empacotam-se em sólidos, são encontradas distâncias definidas de um núcleo ao outro. Portanto, vamos considerar o raio atômico como sendo a metade da distância entre os núcleos de dois átomos vizinhos.
Nas famílias (coluna vertical) os raios atômicos aumentam de cima para baixo, pois, nesse sentido, aumenta o número de níveis de energia dos átomos.
Por exemplo: um átomo do 1o período tem apenas um nível de energia, portanto terá menor raio atômico que um átomo do 2o período (da mesma família) que tem dois níveis de energia.
Nos períodos (linha horizontal), conforme caminhamos para a direita, aumenta o número atômico (número de prótons) para átomos de mesmo número de níveis de energia, portanto aumenta a atração do núcleo pela eletrosfera, diminuindo o tamanho do átomo e conseqüentemente o raio.
Assim, o raio atômico cresce da direita para a esquerda nos períodos.
Esquema:
II. Raios Iônicos
Raio de Cátion
Quando um átomo perde elétron, a repulsão da nuvem eletrônica diminui, diminuindo o seu tamanho. Inclusive pode ocorrer perda do último nível de energia e quanto menor a quantidade de níveis, menor o raio.
Portanto: raio do átomo > raio do cátion
Raio do Ânion
Quando um átomo ganha elétron, aumenta a repulsão da nuvem eletrônica, aumentando o seu tamanho.Portanto: raio do átomo < raio do ânion
Íons Isoelétricos
Íons isoelétricos são os que apresentam igual número de elétrons e, portanto, o número de níveis é o mesmo. Assim, quanto maior for o número atômico, maior será a atração do núcleo pela eletrosfera e menor o raio.
Exemplo
III. Energia (ou Potencial) de Ionização
É a energia necessária para retirar um elétron de um átomo (ou íon) isolado no estado gasoso.
X(g) + energia  X+(g) + e–
X+(g) + e–
Quando retiramos um elétron de um átomo eletricamente neutro (1a energia de ionização) gasta-se uma certa quantidade de energia, a qual, geralmente, é expressa em elétrons-volt (eV). Se formos retirar um segundo elétron (2a energia de ionização), gasta-se uma quantidade maior de energia, pois, à medida que cada e- é retirado, o raio atômico diminui.
Exemplo
Nas famílias e nos períodos, a energia de ionização aumenta conforme diminui o raio atômico, pois, quanto menor o tamanho do átomo, maior a atração do núcleo pela eletrosfera e, portanto, mais difícil retirar o elétron.
Esquema:
IV. Afinidade Eletrônica ou Eletroafinidade
É a quantidade de energia liberada quando um átomo neutro, isolado no estado gasoso, recebe um elétron.
X(g) + e-  X -(g) + energia
X -(g) + energia
A eletroafinidade pode ser entendida como a medida da intensidade com que o átomo captura o elétron.
Nas famílias e nos períodos, a eletroafinidade aumenta com a diminuição do raio atômico, pois, quanto menor o raio, maior a atração exercida pelo núcleo.
Esquema:
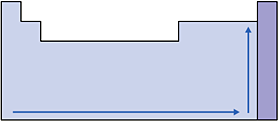
V. Eletronegatividade
É a capacidade que um átomo possui de atrair para si o par de elétrons, compartilhado com outro átomo.
Nas famílias e nos períodos, a eletronegatividade cresce conforme o elemento apresenta o menor raio atômico, com exceção dos gases nobres, pois a atração do núcleo pela camada de valência será maior.
Esquema:
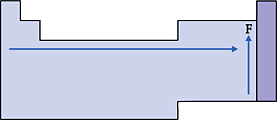
É o volume ocupado por 1 mol de átomos (6,0 · 1023 átomos) do elemento no estado sólido.
Assim, o volume atômico depende, além do volume dos átomos, do espaçamento que ocorre entre eles.
Nas famílias, o volume atômico aumenta de acordo com o aumento do raio.
Nos períodos, o volume atômico aumenta de acordo com o aumento do raio, mais ou menos do centro da tabela para a esquerda; já do lado direito, a variação é oposta, isto é, devido ao maior espaçamento que ocorre entre os átomos, principalmente nos metais.
Esquema:
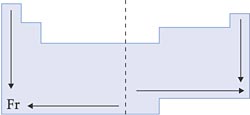
VII. Densidade Absoluta
Densidade (d) de um elemento é a razão entre sua massa (m) e seu volume (V).
Nas famílias, a densidade aumenta de cima para baixo, pois, nesse sentido, a massa cresce mais que o volume.
Nos períodos, a densidade aumenta das extremidades para o centro, pois, quanto menor o volume, maior a densidade, já que a variação de massa nos períodos é muito pequena.
Esquema:
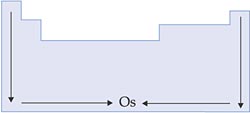
VIII. Pontos de Fusão e de Ebulição
Os pontos de fusão e ebulição são, respectivamente, as temperaturas nas quais o elemento passa do estado sólido para o líquido e do estado líquido para o gasoso.
Nas famílias, os pontos de fusão e de ebulição aumentam de acordo com a densidade, pois, quanto mais denso e compacto o retículo cristalino, mais difícil a separação dos átomos.
Nas famílias dos metais alcalinos e dos alcalinoterrosos, o crescimento é oposto ao das demais.
Nos períodos, os pontos de fusão e de ebulição aumentam também com o aumento da densidade.
Esquema:
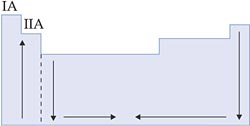
IX. Eletropositividade ou Caráter Metálico
É a capacidade que um átomo possui de doar elétrons.
Nas famílias e nos períodos, a eletropositividade aumenta conforme aumenta o raio atômico, pois, quanto maior o raio, menor a atração do núcleo pela eletrosfera, mais fácil de doar elétrons.
Esquema:
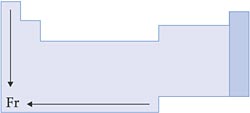
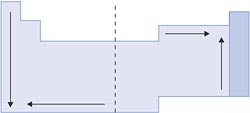
X. Reatividade Química
Um elemento é considerado muito reativo, quando perde ou ganha elétrons com facilidade. Portanto, para os metais, a reatividade aumenta à medida que diminui o potencial de ionização; para os ametais, a reatividade aumenta à medida que aumenta o potencial de ionização.
Esquema:
RESUMO
Lei Periódica
A Tabela Periódica teve como base as propriedades observadas experimentalmente nos elementos. Elementos diferentes têm, em geral, propriedades também diferentes.Há, no entanto, grupos de elementos que apresentam propriedades muito semelhantes; o grupo dos metais alcalinos a que pertence o sódio e o potássio, o grupo dos halogênios de que faz parte o cloro, o bromo e o iodo, etc., etc., os elementos de um mesmo destes grupos têm não só propriedades físicas muito semelhantes como comportamento químico análogo. As propriedades físicas e químicas as dos elementos mostraram ser função periódica do número atômico.
Os elementos de uma mesma coluna da Tabela Periódica, dizem-se congêneres ou da mesma família e formam um grupo da tabela. As propriedades físicas e o comportamento químico dos elementos de um dado grupo são análogos: o que se conhecer acerca das propriedades físicas e químicas de um deles facilitará o estudo de todos os outros.
Ao longo de uma linha horizontal da Tabela Periódica, a variação das propriedades dos elementos processa-se de uma maneira regular. Os elementos que se encontram numa mesma linha horizontal constituem um período.
Na Tabela Periódica, os grupos I e II incluem os elementos de todos os períodos que se situam, respectivamente, na primeira e segunda colunas, a contar da esquerda; os grupos III, IV, V, VII, e VIII incluem os elementos de todos os períodos que formam as seis colunas da Tabela que se situam na sua parte direita.
Os elementos que ocupam a parte central do Quadro Periódico, pertencentes aos períodos largos, designam-se por elementos de transição e têm propriedades diferentes dos elementos representativos.
GRUPO I DA TABELA PERIÓDICA: OS METAIS ALCALINOS
O grupo I da Tabela Periódica é constituído por seis elementos muito semelhantes nas suas propriedades físicas e no seu comportamento químico: o lítio, o sódio, o potássio, o rubídio, o césio e o frâncio. O sódio e o potássio aparecem com abundância na natureza; o lítio, o rubídio e o césio são mais raros; o frâncio só se encontra em vestígios e todos os isótopos que se conhecem são instáveis (radioativo).
1 - Propriedades físicas.
Todos os elementos deste grupo são sólidos à temperatura ambiente, são pouco duros, excelentes condutores do calor e da eletricidade.
2 - Propriedades químicas.
Os metais alcalinos não se encontram livres na natureza devido à sua extrema reatividade. Expostos ao ar oxidam-se rapidamente; por essa razão, só as superfícies recém-formadas apresentam brilho metálico. Têm que se guardar ao abrigo do ar, em petróleo ou tolueno, por exemplo, ou numa atmosfera inerte.
O comportamento químico dos elementos do grupo I é muito homogêneo. Todos eles apresentam uma primeira energia de ionização extremamente pequena, o que indica, por parte do núcleo, uma atração fraca, sobre o elétron de valência.
GRUPO II DA TABELA PERIÓDICA: OS METAIS ALCALINO-TERROSOS
O grupo II da Tabela Periódica comporta seis elementos, o berílio, o magnésio, o cálcio, o estrôncio, o bário e o rádio, muito semelhantes entre si, como acontecia com os metais alcalinos, mas em que a gradação das propriedades é muito mais acentuada, ao longo do grupo. No elemento de maior número atômico, o rádio, tal como acontecia, ainda, no grupo I, com o frâncio, todos os isótopos são instáveis (radioativos).
1 - Propriedades físicas
Todos os elementos deste grupo apresentam caráter metálico acentuado, embora menos que os do grupo I; designam-se por metais alcalino-terrosos. São moles, mas menos que os elementos do grupo I; a dureza, como nos metais alcalinos, decresce ao longo do grupo, à medida que o número atômico cresce. São sólidos à temperatura ambiente, bons condutores do calor e da eletricidade.
2 - Propriedades químicas
Os metais alcalino-terrosos, tal como os metais alcalinos, não se encontram livres na natureza. A causa disso está na grande reatividade que apresentam, inferior, contudo, à dos elementos do grupo I; reagem com numerosas substâncias, principalmente com os elementos não metálicos da parte direita da Tabela Periódica, e reagem, também, com a água; estas reações diferem, das dos metais alcalinos, no vigor com que se processam. A família dos metais alcalino-terrosos é uma família de comportamento químico homogêneo.
GRUPO VII DA TABELA PERIÓDICA: OS HALOGÊNIOS
Este grupo inclui cinco elementos, o flúor, o cloro, o bromo, o iodo e o ástato, dos quais os mais abundantes são o flúor e o cloro. O ástato não aparece na natureza e todos os isótopos que se conhecem são instáveis (radioativos).
Os elementos do grupo VII da Tabela Periódica são designados por halogênios, nome que significa geradores de sais; estes elementos são dotados de grande reatividade química e reagem com quase todos os elementos formando haletos. Os haletos dos elementos metálicos são iônicos; é a partir destes sais que normalmente se obtêm os halogênios, pois não existem livres na Natureza.
1 - Propriedades físicas
No estado elementar os halogênios existem sob a forma de moléculas diatômicas que apresentam grande estabilidade; sob este aspecto, são semelhantes aos átomos dos gases inertes e aos íons dos metais alcalinos e alcalino-terrosos.
O estado físico dos halogênios varia gradualmente ao longo do grupo: o primeiro elemento, o flúor, é um gás à temperatura ambiente e é difícil de liquefazer; o segundo elemento, o cloro, é ainda gasoso à temperatura ambiente mas é substancialmente mais fácil de liquefazer; o terceiro elemento, o bromo, é líquido e o quarto, o iodo, é sólido. Todos estes elementos são muito tóxicos produzindo queimaduras difíceis de curar.
2 - Propriedades químicas
Os halogênios são muito reativos; o seu comportamento químico está de acordo com as energias de ionização e afinidades eletrônicas elevadas que os átomos apresentam. Devido à sua grande reatividade, estes elementos não se encontram livres na Natureza. Formam compostos binários praticamente com quase todos os elementos e a reação processa-se, muitas vezes, de maneira espontânea, à temperatura ambiente.
O HIDROGÊNIO, UM ELEMENTO SINGULAR NA TABELA PERIÓDICA
O hidrogênio, o primeiro elemento do Quadro Periódico, apresenta uma configuração eletrônica muito especial. Por ter um único elétron na camada de valência, ela assemelha-se à configuração eletrônica dos metais alcalinos; por lhe faltar apenas um elétron para preencher completamente a camada de valência, a configuração eletrônica do hidrogênio assemelha-se à de um halogênio.
A química do hidrogênio mostra que ele se assemelha, aos metais alcalinos e não aos halogênios. É por esta razão que o hidrogênio se coloca, na Tabela Periódica, no grupo I. Na realidade, ele constitui, em si só, uma família distinta e não se enquadra, verdadeiramente, em nenhum grupo da Tabela Periódica.
GRUPO VIII DA TABELA PERIÓDICA: OS GASES INERTES
Os gases inertes, o hélio, o néon, o argônio, o criptônio, o xenônio e o radônio, constituem o grupo VIII da Tabela Periódica. Existem na atmosfera, como gases não combinados; as suas moléculas, no estado elementar, são monoatômicas, isto é, os átomos encontram-se isolados, sem se ligarem uns aos outros.
Tal como acontece nos grupos I, II e VII, também, neste grupo, o elemento de maior número atômico, o radônio, é instável (radioativo). Todos os compostos formados à custa de um gás nobre mostram pequena estabilidade; é, contudo suficiente para se poderem estudar as suas propriedades. Por decomposição, estes compostos põem em liberdade o gás inerte.
ELEMENTOS DO TERCEIRO PERÍODO
Os elementos que constituem um dado grupo na Tabela Periódica apresentam entre si propriedades semelhantes; faz-se, contudo, sentir certa gradação nessas propriedades, à medida que o número atômico varia.
Essa gradação não é igualmente acentuada em todos os grupos: no grupo I quase se não faz sentir, como tivemos ocasião de observar; nota-se nitidamente no grupo II e é flagrante no grupo VII. Ao longo de um período, os elementos apresentam grandes diferenças entre si: os elementos da parte esquerda, elementos metálicos, são substancialmente diferentes dos elementos da parte direita, os não metais. A variação nas propriedades, desde uns até aos outros, vai-se fazendo, gradualmente, ao longo de um período.