Álcool
O álcool (do árabe al-kohul) é uma classe de compostos orgânicos que possui, na sua estrutura, um ou mais grupos de hidroxilas ("-OH") ligados a carbonos saturados.1 É, comumente, utilizado como combustível, esterilizante e solvente. É o componente principal das bebidas alcoólicas.
Tipos
- álcool etílico é o tipo de álcool mais comum. Está contido nas bebidas alcoólicas, é usado para limpeza doméstica e também é combustível para automóveis. A fórmula do álcool etílico é CH3CH2OH.
- O (metanol) ou (álcool metílico) é um álcool que não deve ser ingerido, pois é extremamente tóxico para o fígado. A fórmula do metanol é (CH3OH).
- Os dois exemplos acima são casos particulares de álcoois do tipo ,(R-OH, em que R-) é um radical alquila.
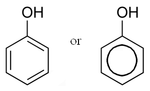
- No fenol, de fórmula química é (C6H6O), a hidroxila está ligada a um anel benzênico. Na maioria dos textos, este composto não é considerado um álcool.
- Álcool anidro é um álcool com até 1% de água (já que é difícil a obtenção de álcool totalmente puro), e pode ser adicionado à gasolina para aumento da octanagem, atuando como antidetonante, para que a gasolina possa ser comprimida no pistão do motor carburante ao máximo e não entre em combustão antes de acionada a vela do motor.
- O álcool bornílico é obtido ligado com o hidroterpendio que corresponde a cânfora.
- O álcool desnaturado é uma composição com o metileno.
Classificação
Álcoois primários
Os álcoois primários têm o grupo hidroxila ou oxidrila ligado a um carbono primário, como por exemplo o etanol. Sua fórmula geral é: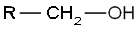 (Na figura, "R" representa um radical hidrocarboneto qualquer)
(Na figura, "R" representa um radical hidrocarboneto qualquer)
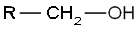 (Na figura, "R" representa um radical hidrocarboneto qualquer)
(Na figura, "R" representa um radical hidrocarboneto qualquer)
Álcoois secundários
A fórmula geral dos álcoois secundários é:  , onde "R" representa um radical hidrocarboneto qualquer.
, onde "R" representa um radical hidrocarboneto qualquer.
Os álcoois secundários têm o grupo hidroxila ligado a um carbono secundário (isto é, um átomo de carbono queestá ligado a apenas dois outros átomos de carbono), como é o caso do 2-propanol:
Os álcoois secundários têm o grupo hidroxila ligado a um carbono secundário (isto é, um átomo de carbono queestá ligado a apenas dois outros átomos de carbono), como é o caso do 2-propanol:
Álcoois terciários
Os álcoois terciários têm o grupo hidroxila ligado a um carbono terciário. Como o 2-metil-2-propanol e o trimetilcarbinol. A fórmula geral é representada com "R", representa um radical hidrocarboneto qualquer)2=composição.
Nomenclatura
A Nomenclatura IUPAC dos álcoois é baseada na dos hidrocarbonetos de que derivam: basta substituir a letra "o" do final por "ol". Se essa nomenclatura for ambígua quanto à posição da hidroxila, o sufixo "ol" deve ser por ela precedido. Por exemplo, propan-2-ol indica um grupo hidroxila ligado ao carbono 2 do propano. Também pode ser escrito 2-propanol.
Em certos casos, pode ser necessário usar a nomenclatura na forma prefixal. Nesse caso, deve-se usar o prefixo "hidróxi". Por exemplo, se tivermos um grupo hidroxila ligado a um anel benzênico, podemos usar o nome "hidróxibenzeno" (essa substância é usualmente conhecida como "fenol").
Em outros casos, o álcool possui outros sufixos, dependendo da quantidade de grupos hidroxila.
-"ol": quando a cadeia possui apenas um grupo hidroxila.
Ex: Etanol(CH3-CH2-OH)
-"Diol": quando existem dois grupos hidroxila na cadeia carbônica.
Ex: Pentano-1,2-diol
-"Triol": quando a cadeia possui três grupos hidroxila.
Ex: Hexano-1,2,3-triol
Produção
Caminhão transportando cana-de-açucar
O álcool é produzido a partir matérias primas com origem vegetal que possuem altos índices de frutose. A principal matéria prima utilizada é a cana-de-açucar, mas existe também o uso de outras matérias como o milho, a mandioca e o eucalipto.
Após o corte, é feito o transporte da matéria para a usina, onde ocorre a lavagem e a moagem seguida da filtragem, de onde são obtidos a garapa e o bagaço. A garapa é aquecida, formando um líquido viscoso e rico em açúcar, o melaço. Depois, adiciona-se ao melaço um pouco de água e ácido, de onde obtemos o mosto. Após 50 horas de fermentação 13% do mosto torna-se álcool e é enviado para a destilação.
Para obter o álcool etílico a partir da mistura é feita uma destilação fracionada. Para o álcool puro ou anidro, retira-se a água excedente. O processo consiste na adição de cal vivo à mistura que ao entrar em reação com a água forma o hidróxido de cálcio que não é solúvel em álcool, assim formando uma mistura heterogênea que é separada.4 O álcool produzido é quantificado através de medidores de vazão ou tanques calibrados e depois enviados para o armazenamento, onde aguardam a posterior remoção por meio de caminhões para a comercialização.
Cada litro de álcool obtido na destilação produz cerca de 12 litros de resíduos que e recebem o nome de vinhaça e são aproveitados como fertilizante no próprio canavial.3
Consumo pelo ser humano
Caipirinha, bebida alcoólica à base de limão, cachaça (ou vodca), gelo e açúcar
O álcool é uma droga depressora do sistema nervoso central que causa desinibição e euforia quando ingerido na forma de bebidas alcoólicas pelos seres humanos. Em doses mais altas, o álcool é prejudicial a saúde, podendo causar estupor e até coma. Os efeitos do álcool são percebidos em dois períodos: um de estímulo e outro de depressão. No primeiro período, o usuário se torna eufórico e desinibido. No segundo momento, ocorre descontrole, falta de coordenação motora e sono.
Em caso de suspensão do consumo, pode ocorrer a síndrome da abstinência, caracterizada por confusão mental, visões, ansiedade, tremores e convulsões.
Os efeitos agudos do consumo do álcool são sentidos em órgãos como o fígado, coração, vasos e estômago. Segundo a OMS, o consumo de álcool quando superior a 60 gramas por semana é considerado abusivo e extremamente nocivo para a saúde. No mundo, 11,5 % dos consumidores de álcool bebem em excesso semanalmente. Estima-se que pelo menos 2,5 milhões de pessoas em todo o mundo morrem por ano por causa do consumo inadequado de álcool.
Álcool Combustível
Para o uso em motores de combustão interna, o álcool tem uma proporção estequiométrica de 8,4 partes de ar para uma de álcool, enquanto gasolina é de 13,5 de ar para uma de gasolina, portanto o motor convertido para álcool ou é reduzida a entrada de ar ou aumentado a quantidade de combustível injetado, em dias atuais uma conversão de gasolina para álcool basicamente é feito o aumento da taxa de compressão para 2 pontos acima da taxa de compressão para gasolina e abrir os bicos injetores ou giclês de carburação em 20 %. O sistema de arrefecimento é reforçado em 10 % em toda a tubulação. O álcool é corrosivo: assim, tanques de combustível devem receber tratamento ou ser feitos de plástico, bombas devem ser mais resistentes e carburadores recebem banho de níquel. A parte interna do motor não necessita de um tratamento anticorrosivo, pois, quando o combustível chega no motor, já está acima do seu ponto de ebulição e no estado de gás, que não é corrosivo. Tem a vantagem de ser uma fonte de energia renovável e causar menor poluição que os combustíveis fósseis.
Impacto Ambiental
Atualmente, há correntes que questionam o impacto ambiental do álcool combustível, pelos severos danos do desmatamento necessário para abrir espaço à monocultura de cana-de-açúcar e pelo efeito nocivo da queima da palhada, necessária para se preparar a cana para a produção de álcool. Esses danos hoje já se fazem sentir, apesar de a utilização do álcool ser ínfima se comparada aos derivados de petróleo. Contudo, a queima da palhada está decaindo com o aumento da mecanização da lavoura. Também deve-se levar em conta o fato de que o efeito da queima é minimizado pela absorção de CO2 através da fotossíntese realizada pela própria cana-de-açúcar.
Fenol
Hidroxibenzeno
(ácido carbólico) é uma função orgânica caracterizada por uma ou mais hidroxilas ligadas a um anel aromático. Apesar de possuir um grupo -OH característico de um álcool, o fenol é mais ácido que este, pois possui uma estrutura de ressonância que estabiliza a base conjugada.São obtidos principalmente através da extração de óleos a partir do alcatrão de hulha.
Fenol também é o nome usual do fenol mais simples, que consiste em uma hidroxila ligada ao anel benzênico. Outros nomes para a mesma substância incluem: benzenol; ácido carbólico; ácido fénico (ou ácido fênico, no Brasil); ácido fenílico; hidroxibenzeno; monohidroxibenzeno. Sua fórmula molecular é C6H5OH
Geralmente os fenóis são sólidos, cristalinos, tóxicos, cáusticos e pouco solúveis em água.
Produção do hidroxibenzeno
O fenol (hidroxibenzeno) pode ser produzido da oxidação parcial do benzeno, pelo processo do cumeno, ou pelo processo Raschig-Hooker. Ele pode também ser encontrado como um produto da oxidação do carvão mineral.
Efeitos potenciais à saúde
O fenol (hidroxibenzeno) é corrosivo e irritante das membranas mucosas. Potencialmente fatal se ingerido, inalado ou absorvido pela pele. Causa queimaduras severas e afeta o sistema nervoso central, fígado e rins.
Também é extremamente tóxico para animais como os gatos.
Substância pode provocar a longo prazo câncer de diversos tipos.
Inalação
Provoca dispnéia e tosse. A absorção sistêmica provoca danos ao fígado, rins e sistema nervoso central.
- Cuidados:
- Remover o indivíduo ao ar livre. Se não estiver respirando, fazer respiração artificial.
- Se for ingerido, dar óleo de rícino ou polietileno glicol.
Contato com a pele
Pode provocar desde uma eritema até necrose e gangrena dos tecidos, dependendo do tempo de contato e da concentração das soluções. O maior perigo do fenol é a habilidade de penetrar rapidamente na pele, causando severas lesões que podem ser fatais.
- Cuidados:
- Usar polietilenoglicol, não recomendavél usar água, pois o mesmo é pouco solúvel, fazendo aumentar a área atingida Lavar imediatamente em água corrente por, pelo menos, 30 minutos.
- Remover a roupa contaminada e os sapatos destruindo-os depois.
- Procurar ajuda médica.
- Se você não se tratar pode morrer com derrame cerebral.
Contato com os olhos
Pode provocar inchaço da conjuntiva; a córnea torna-se branca e muito dolorida, podendo ocorrer perda de visão.
- Cuidados:
- Lavar imediatamente com água corrente por, pelo menos, 15 minutos, abrindo e fechando ocasionalmente as pálpebras.
- Procurar ajuda médica imediatamente.
Recomendações ao médico: Fazer uma lavagem gástrica usando 40% de leite ou água. Fazer um eletrocardiograma. Monitorar sinais vitais, funções hepáticas e renais. Michele Helena Braga
Propriedades do hidroxibenzeno
Nomenclatura e exemplos
De acordo com a nomenclatura oficial IUPAC os fenóis podem ser nomeados usando o anel aromático como cadeia principal e os grupos ligados a ele como radicais, seguindo a linha: radical-fenol ou radical-hidroxi + nome do anel aromático (benzeno, naftaleno e etc).
Exemplo: 2-metil-fenol ou 2-metil-hidroxibenzeno.
Propriedades físicas
Os fenóis mais simples são líquidos ou sólidos de baixo ponto de fusão e ponto de ebulição elevado, devido à ligação das moléculas, umas às outras, por ligações de hidrogênio. São, em geral, pouco solúveis ou insolúveis em água, de cheiro forte e característico. São tóxicos e têm ação cáustica sobre a pele. A menos que exista na molécula algum grupo susceptível de produzir cor, os fenóis são incolores. Se oxidam facilmente, como as aminas, e muitos fenóis apresentam cor devido à presença de produtos de oxidação corados.
Propriedades químicas
Os fenóis têm caráter relativamente ácido, porém, menos ácido que os ácidos carboxílicos Os fenóis podem ser facilmente diferenciados dos álcoois por meio de alguns testes simples em laboratório.
Aplicações
Os fenóis encontram diversas aplicações práticas, tais como:
- Desinfetantes (fenóis e cresóis)
- Preparação de resinas e polímeros, como a baquelite.
- Preparação do ácido pícrico, usado na preparação de explosivos
- Síntese da aspirina e de outros medicamentos
- Utilizado como catalisador
- Entre os diidroxifenóis, a hidroquinona é a mais importante. A partir dela se produzem as quinonas, que são compostos coloridos, variando do amarelo ao vermelho. Não apresentam caráter aromático, sendo fortemente insaturados. A ação redutora da hidroquinona, que à temperatura ambiente age com grande rapidez sobre os sais de prata, faz dela um revelador fotográfico de largo emprego.
Enfim, numerosos derivados do fenol estão difundidos na natureza; entre estes o eugenol e o isoeugenol, que constituem essências de cravo e noz-moscada.
Houve referências que o ácido carbólico (fenol) pudesse ter sido utilizado por certos estigmatizados para produzirem suas chagas. Porém, os efeitos para a saúde (com risco de envenenamento geral) justificam a falta de aceitação dessas explicações cépticas (carece de fontes).
Aldeído
Aldeído é uma função orgânica que se caracteriza pela presença, em sua estrutura, do grupamento H—C=O (formila ou formilo), ligado a um radical alifático ou aromático.
A fórmula bruta dos aldeídos corresponde a um álcool com dois átomos de hidrogênio a menos.
Aldeído:O=C-H (Com conexão no Carbono(c))
O odor dos aldeídos que têm baixo peso molecular é irritante, porém, à medida que o número de carbonos aumenta, torna-se mais agradável. Os aldeídos de maior peso molecular, que possuem de 8 a 12 átomos de carbono, são muito utilizados na indústria de cosméticos na fabricação de perfumes sintéticos.
Obtenção
É obtido através da oxidação de álcoois primários em meio ácido ou de sua desidrogenação catalítica na forma de vapor em presença de metais como o cobre, a prata e a platina, ou da oxidação catalítica de vapores de álcoois por oxigênio do ar, igualmente na presença de cobre, prata ou platina aquecidos, como por exemplo, para o etanol resultando no etanal:
C2H5OH + [O] → C2H4O + H2O
Nomenclatura
Os aldeídos mais simples são designados a partir dos ácidos carboxílicos correspondentes. Assim, o composto derivado do ácido butírico é chamado de aldeído butírico ou butiraldeído.1
Segundo a nomenclatura IUPAC, o nome de um aldeído é obtido substituindo-se a terminação "o" do hidrocarboneto correspondente por "al". Nos compostos que apresentam ramificações, considera-se como principal a cadeia que contém o grupo funcional, iniciando-se nela a numeração.
Exemplos:
- HCHO: metanal ou formaldeído
- CH3CH2COH: propanal
- HOC-CH2-CH2-COH: butanodial (note que a numeração não é necessária, já que a função aldeído só pode estar na extremidade da cadeia)
Quando não for possível usar a forma sufixal, há ainda duas alternativas:
- Usar o sufixo -carbaldeído. Por exemplo, HOC-CH2CH2CH(CHO)CH2CHO poderia ser nomeado como butano-1,2,4-tricarbaldeído. Note que, dessa maneira, excluímos da cadeia os carbonos da formila.
- Usar o prefixo formil-. Por exemplo, poderíamos nomear o mesmo composto do exemplo anterior como 3-(formilmetil)hexanodial, considerando como parte da cadeia principal dois grupos formila.
Nomenclatura usual:
- Metanal-aldeído formíco
- Etanal-Aldeído Acético ou acetaldeído
- Propanal-Aldeído propionico ou propionaldeido
- Butanal-Aldeído Butiríco
- Pentanal-Aldeído Valérico ou Valeraldeído
- Etanodial-Oxaladeído
- Fenil-metanal--Benzaldeído.
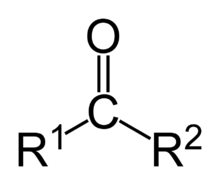
Cetona
As cetonas são compostos orgânicos caracterizados pela presença do grupamento —C(=O)—, carbonila, ligado a dois radicais orgânicos. Apresentam uma fórmula geral R—C(=O)—R', em que R e R' podem ser iguais (cetonas simples ou simétricas) ou diferentes (cetonas mistas ou assimétricas); alifáticos ou aromáticos; saturados ou insaturados. R e R' podem também estar unidos. Nesse caso, compõem um ciclo (cetonas cíclicas).
Quando R ou R' é um átomo de hidrogénio, trata-se de um aldeído.
Formação
Cetonas são formadas pela oxidação de álcoois secundários. Um átomo de hidrogênio (ligado ao oxigênio) é retirado e o átomo de oxigênio passa a fazer uma ligação dupla com o carbono da cadeia.
Nomenclatura
A nomenclatura desses compostos é feita fundamentada na dos hidrocarbonetos, apenas trocando o sufixo "o" por "ona". Quando houver ambigüidade na posição do grupo carbonila, esta deve ser indicada antes do sufixo, da mesma maneira que em outras funções orgânicas. Seguem alguns exemplos de cetonas:
- propanona (popularmente acetona): CH3-CO-CH3
- butanona: CH3-CO-CH2-CH3
- pentan-2-ona: CH3-CO-CH2-CH2-CH3
- pentan-3-ona: CH3-CH2-CO-CH2-CH3
- hexan-2-ona: CH3-CO-(CH2)3-CH3
- hexan-3-ona: CH3-CH2-CO-(CH2)2-CH3
- butanodiona (também conhecido por diacetilo): CH3-CO-CO-CH3
- pentan-2,4-diona: CH3-CO-CH2-CO-CH3
Quando o composto tiver mais de uma função e uma delas tiver maior precedência que a função cetona, deve-se usar o prefixo oxo. Por exemplo:
- CH3-CO-CH2-COOH: ácido 3-oxobutanóico (também chamado de ácido acetoacético).
- CH3-CH2-CO-CH(CH3)-COH: 2-metil-3-oxopentanal.
Nomenclatura usual
Também existe as nomenclaturas usuais "(radical menor)'(radical maior)cetona".
Exemplo:
- CH3–CO–CH2CH2CH3: metilpropilcetona. A nomenclatura oficial correspondente seria pentan-2-ona.
Ácido carboxílico


Em fórmulas químicas, esses grupos são tipicamente representados como COOH ou CO2H.
Moléculas que possuem tal grupo funcional também são chamadas ácidos carboxílicos ou ácidos orgânicos.
Fórmula geral: R é um radical orgânico alquila, alquenila, arila ou hidrogênio.
- COOH é o grupo funcional carboxila.
R - CO- é um radical orgânico acila.
Estrutura molecular
Os dois átomos eletronegativos de oxigênio tendem a influênciar as propriedades do hidrogénio do grupo -OH aumentando a sua polarização,e facilitando a perda do protão H. A carga negativa restante é então distribuída igualmente entre os dois átomos de oxigênio, e as duas ligações carbono-oxigênio adquirem características de dupla ligação parcial (i.e., elas são deslocalizadas).
Esse é um resultado da estrutura ressonante criada pelo componente carbonila do ácido carboxílico, sem o qual o grupo OH não pode perder tão facilmente seus H+ (veja álcool). Ao grupo COO- denomina-se-lhe carboxilato. O íon resultante é tipicamente nomeado com o sufixo "-ato", como ácido acético, por exemplo, tornando-se íon acetato.
Propriedades
Propriedades físicas
São geralmente ácidos fracos, com apenas 1% de moléculas RCOOH dissociadas em íons a temperatura ambiente em solução aquosa.
- São substâncias polares.
- Podem, como os álcoois, formar dupla ligações de hidrogênio entre si ou com moléculas de outra espécie. Por essa razão, os ácidos carboxílicos apresentam praticamente o mesmo comportamento dos álcoois, quanto à solubilidade.
- Os ácidos com até 4 carbonos são líquidos incolores, miscíveis com a água. Os ácidos de 5 a 9 carbonos são líquidos incolores e viscosos, muito pouco solúveis. Os ácidos com dez ou mais carbonos são sólidos brancos, semelhante à cera, insolúveis em água.
- O ácido aromático mais simples, o ácido benzóico, por apresentar já elevado número de carbonos, não tem apreciável solubilidade em água. Os ácidos carboxílicos são solúveis em solventes menos polares, como o éter, o álcool, o benzeno.
- Os ácidos alifáticos têm odor fraco ficando progressivamente de forte e irritante nos ácidos fórmico e acético. O odor se torna extremamente desagradável (semelhante à manteiga rançosa) nos ácidos butírico (4C), valérico (5C) e capróico (6C). Os ácidos com mais que 6 carbonos não têm muito odor, por serem pouco voláteis.
- Comparando-se um ácido carboxílico e um álcool, ambos com o mesmo número de carbonos, o ácido terá maior ponto de ebulição, devido à formação de duas ligações de hidrogênio e não apenas uma, como no álcool.
Propriedades químicas
Reagem com bases para formar carboxilatos sais, nos quais o hidrogênio do grupo -OH é substituído por um ion metálico. Deste modo, ácidos etanóicos/acéticos reagem com bicarbonato de sódio para formar etanoato sódico (acetato de sódio), dióxido de carbono e água:
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
- Grupos carboxila também reagem com grupos amina para formar ligações peptídicas e com álcoois para formar ésteres.
Classificações e nomenclaturas
Ácidos monocarboxílicos
Identificação
São aqueles que apresentam na sua estrutura um único grupo funcional carboxila, onde R é um substituinte orgânico alquila, alquenila, arila ou hidrogênio.
Apresentam formula geral R - COOH
Nomenclatura
Oficial: Ácido (nome da cadeia carbônica derivada do hidrocarboneto) + ÓICO e vem acompanhado pelo nome do numero de carbonos existentes. ex.: CH3-CH2-COOH (ácido propanóico) em que PROP é usado pela existencia de 3 carbonos, AN por ser uma ligação simples e ÓICO por estar no grupo carboxila.
Exemplo:
CH3 - COOH
Nomenclatura oficial: ácido etanóico (cadeia derivada do hidrocarboneto etano)
Nomenclatura usual: ácido acético ( do latim acetum que significa azêdo)
Principais ácidos monocarboxílicos
Ácidos dicarboxílicos
Identificação
São os ácidos carboxílicos que apresentam na sua estrutura dois grupos funcionais carboxila, onde R é um radical orgânico.
Apresentam formula geral HOOC - R - COOH
Nomenclatura
Oficial: Ácido (nome da cadeia carbônica derivado do hidrocarboneto)DIÓICO
Usual: Nome , em geral,de origem do latim ou do grego.
Exemplo: HOOC - CH2 - COOH
Nomenclatura oficial: Ácido propanodióico (cadeia derivada do hidrocarboneto propano )
Nomenclatura usual: Ácido malônico
Nomenclatura usual: Ácido propanílico
Principais ácidos dicarboxílicos
Ácidos graxos
Ácidos com outros grupos funcionais
- Ácido láctico ou ácido 2-hidroxi-propanóico:
CH3 - CH ( OH ) - COOH
- Ácido tartárico ou ácido dihidróxi-butanodióico:
HCOO - CH ( OH )- CH ( OH ) - COOH
- Ácido salicílico ou ácido Para-hidróxi-benzóico
HO - ( C6H4 ) - COOH
- Ácido tricloroacético ou ácido tricloroetanóico:
CCl3 - COOH
- Ácido cítrico ou ácido 2- hidroxi-propanotrióico:
HOOC - ( OH ) CH ( COOH ) - COOH
- Aminoácido ou ácido 2-amino-nome do radical acila
R - CH ( NH2 ) - COOH
Os grupos carboxilos reagem com os grupos amino para formar amidas. No caso de aminoácidos que reagem com outros aminoácidos para dar proteínas, a este enlace de tipo amida que se forma, denomina-se enlace peptídico. Igualmente, os ácidos carboxílicos podem reagir com álcoois para dar ésteres, ou bem com halogenuros para dar halogenuros de ácido, ou entre si para dar anidridos. Os ésteres, anidridos, halogenuros de ácido e amidas chamam-se derivados de ácido. • HCOOH ácido fórmico (encontra-se em insectos, fórmico refere-se às hormigas) • CH3COOH ácido acético ou etanoico (encontra-se no vinagre) • HOOC-COOH ácido etanodioico, também chamado ácido oxálico, • CH3CH2COOH ácido propanoico • C6H5COOH ácido benzoico (o benzoato de sodio, o sal de sodio do ácido benzoico se emprega como conservante) • Ácido láctico • Todos os aminoácidos contêm um grupo carboxilo e um grupo amino. Quando reage o grupo carboxilo de um aminoácido com o grupo amino de outro se forma um enlace amida chamado enlace peptídico. As proteínas são polímeros de aminoácidos e têm em um extremo um grupo carboxilo terminal. • Todos os ácidos graxos são ácidos carboxílicos. Por exemplo, o ácido palmítico, esteárico, oleico, linoleico, etcétera. Estes ácidos com a glicerina formam ésteres chamados triglicéridos.
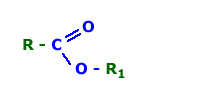
ÉSTER
Os ésteres são compostos orgânicos cujas moléculas possuem o grupo acilato (COO) ligado a dois radicais orgânicos (iguais ou não) ou a um radical orgânico e um hidrogênio.
O grupo acilato dispõe-se na cadeia carbônica como um grupo carbonilo ligado ao oxigênio (heteroátomo). Assim, a fórmula geral dos ésteres é RCOOR’:
De modo semelhante á classe dos enóis, muitos ésteres possuem odor agradável característicos de frutos e podem ser obtidos através dos extratos de plantas que têm na sua composição ésteres de ácidos carboxílicos e alcoóis de baixa massa molecular.
Nomenclatura Oficial
Para o radical R sem ramificações, deve-se nomeá-la de acordo com o número de átomos de carbono; determina-se a saturação das ligações, para em seguida, completar com o radical R’.
Caso o radical R seja ramificado, deve-se nomear os radicais de acordo com a posição na cadeia (numerando-se os átomos de carbono); nomear a cadeia R quanto ao número de átomos de carbono; determinar a saturação das ligações e complementar com o radical R’.
Para ambos os casos, deve-se completar a nomenclatura de todo o radical R com o sufixo ATO. Exemplos:
Nomenclatura Usual
Os éteres mais comuns recebem determinadas nomeações para o radical R que fogem da nomenclatura oficial.
Obtenção
Os ésteres são obtidos pela ação de um ácido orgânico ou inorgânico sobre um álcool, com liberação de água. Assim, para que a reação seja catalisada, pode-se adicionar ácido clorídrico (HCl) que, a partir da sua dissociação, aumenta a concentração de íons H+ no meio e desloca o equilíbrio da reação para o lado da formação do éster:
Observe que a reação de esterificação acima não é 100% completa (assim como nenhuma outra). Portanto, coexistem num equilíbrio dinâmico o ácido acético, o álcool etílico, o etanoato de etila e a água líquida.
A reação de saponificação, em meio básico, chega muito mais perto de 100% de eficiência que a de esterificação. Consistindo na reação de um éster (de origem vegetal ou animal) com uma base de Arrhenius:
CH3-COO-CH3 + NaOH → [CH3-COO][Na] + CH3-OH
Na saponificação há formação de um sal orgânico e um álcool. Sendo muito utilizada na indústria de produtos de limpeza (sabões e detergentes), alimentícia e de medicamentos.
ÉTER
A ligação característica de um éter é um grupo –O– que conecta dois radicais de hidrocarbonetos, sendo, portanto, um heteroátomo (um átomo é heteroátomo quando está no meio de carbonos numa cadeia, mas não é um carbono nem um hidrogênio).
A nomenclatura dos éteres é dada unindo o nome da cadeia mais simples (prefixo + oxi) + o nome da cadeia mais complexa (prefixo + infixo + o).
met (do C da cadeia da esquerda) + oxi (sufixo da cadeia mais simples) + et (dos 2 C da cadeia da direita) + an(das simples ligações) + o (sufixo da cadeia mais complexa)
Os éteres estão entre os mais perigosos produtos químicos, principalmente devido à sua inflamabilidade e natureza explosiva.
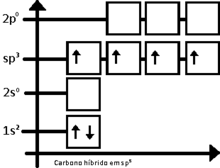
Hibridação sp3[editar]
A hibridação sp3 é facilmente explicada pelo carbono. Para o carbono tetraédrico (como no metano, CH4), deve haver quatro ligações simples. O problema é que a distribuição eletrônica do carbono no estado fundamental é 1s2 2s2 2px1 2py1, esquematizando: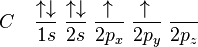
(Nota: O orbital 1s tem menos energia que o 2s, que por sua vez tem menos energia que os orbitais 2p)
Dessa forma, o carbono deveria realizar apenas duas ligações, ao que há apenas dois orbitais semipreenchidos. Entretanto, a molécula de metileno (CH2) é extremamente reativo, não estando equilibrado quimicamente. O primeiro passo para se entender o processo de hibridação, é excitar o átomo de carbono em questão, tendo-se:

Então, o carbono equilibra os quatro orbitais, dando origem a orbitais de energia intermediária entre 2s e 2p, dando origem ao orbital sp3 (lido s-p-três), assim chamado por ser o resultado da fusão de um orbital s com três orbitais p. Portanto, tem-se:

Hibridação sp2[editar]
Outras formas de hibridação são explicadas de forma semelhante à sp3 do metano. A hibridação sp2 é realizada quando um dos orbitais p não hibrida. Isso acontece em moléculas como a de eteno, na qual há ligação dupla entre carbonos.A fórmula estrutural dessa molécula é algo parecido com a mostrada aqui:
Não são todos os orbitais que hibridam, pois os orbitais híbridos formam apenas ligações σ é necessária para a ligação dupla entre os carbonos. Sua distribuição eletrônica ficará algo como esta abaixo. Temos as ligações tetraédrica, trigonal plana e linear plana respectivamente (109,28)°,120°,180°.
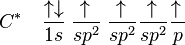







Nenhum comentário:
Postar um comentário