O NASCIMENTO DA QUÍMICA
A Lei de Lavoisier: No interior de um recipiente fechado, a massa total não varia, quaisquer que sejam as transformações que venham a ocorrer.
A soma das massa antes da reação é igual à soma das massa após a reação.
" na natureza, nas se perde, nada se cria; a matéria apenas se transforma."
28 gramas de N2 + 6 gramas de H2 ↔ 34 gramas de NH3
28 gramas de N2 + 6 gramas de H2 ↔ 34 gramas de NH3
A Lei de Proust: Uma determinas substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa.
São denominadas Leis ponderais, porque falam em massa das substâncias envolvidas. São leis importantíssimas, pois marcam o início da química como ciência.
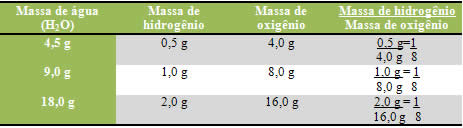
Observe que não importa a quantidade de massa dos elementos usada, a proportção sempre será a mesma.

Observe que não importa a quantidade de massa dos elementos usada, a proportção sempre será a mesma.
A HIPÓTESE DE DALTON
Cientista inglês John Dalton: Todo e qualquer tipo de matéria é formado por partículas indivisíveis, chamadas átomos.
Podemos dizer também que Dalton criou um modelo para o átomo, hoje chamado de modelo atômico de Dalton.
Para Dalton, cada átomo seria uma partícula extremamente pequena, maciça, indivisível e eletricamente neutra .
Obs. Os átomos são tão pequenos que em 1 g de ferro, existem aproximadamente 10.800.000.000.000.000.000.000 átomos desse metal. Isso equivale a dizer que, se a cabeça de um alfinete tivesse o tamanho do nosso planete, o átomo teria o tamanho de uma bola de futebol. Podemos então afirmar que nosso mundo macroscópico pode se explicado pela existência de partículas indivisíveis (mundo microscópico).


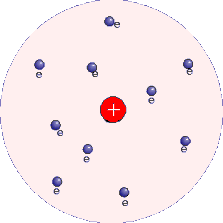
MODELO ATÔMICO DE THOMSON
Joseph John Thomson, baseado na sua descoberta do elétron e na descoberta da radioatividade, sugeriu que o átomo deveria ser formado por uma esfera positiva, não maciça e "incrustada" de elétrons (carga negativa), de modo que a carga total fosse nula.

O modelo de Thomson explicava os seguintes fenômenos:
- Eletrização por atrito, entendendo-se que o atrito separava cargas elétrica
- Corrente elétrica: Vista como um fluxo de elétrons.
- Formação de íons: negativos ou positivos conforme tivessem, respectivamente, excesso ou falta de elétrons.
- Descarga elétrica em gases: Quando os elétrons são arrancados de seus átomos.
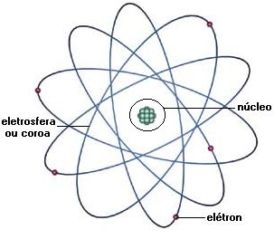
MODELO ATÔMICO DE RUTHERFORD
Realizou experiências bombardeando uma finíssima lâmina de ouro com partículas alfa , cuja carga elétrica é positiva(2+), emitidas pelo polônio, um material radioativo.

Através dessa experiência, Rutherford observou que:
- A maioria das partículas alfas atravessou a placa de ouro sem sofrer desvio consideravel em sua trajetória;
- Algumas partículas alfas (poucas), foram rebatidas na direção contrária ao choque;
- Certas partículas alfas (poucas); sofreram um grande desvio em sua trajetória inicial.
Conclusão: No átomo há grandes espaços vazios. A maioria das partículas alfas atravessou a placa.
No centro do átomo existe um núcleo muito pequeno e denso. Algumas poucas partículas alfas foram rebatidas. E que o núcleo do átomo tem carga positiva. As partículas alfas, que possuem cargas positivas, quando passavam perto do núcleo, eram repelidas sofrendo desvio em sua trajetória.
Rutherford admitiu que havia elétrons girando ao redor do núcleo para equilibrar sua carga positiva.
As partículas positivas do núcleo foi Rutherford que as chamou de prótons.
MODELO ATÔMICO DE BOHR
Logo notou-se uma contradição no modelo de Rutherford. O elétron em movimento circular estaria sujeito à aceleração centrípeta e iria emitir energia até cair no núcleo. O sistema atômico entraria em colapso e a matéria estaria comprometida na sua estrutura básica.
Mas isso não ocorre Niels Bohr criou um novo modelo atômico baseado em espectros de emissões.


MODELO ATÔMICO DE RUTHERFORD- BOHR
Em 1911, Rutherford apresentou a sua teoria para o seu modelo atômico, afirmou que o modelo vigente até então, também conhecido como "pudim de passas", que foi feito por J. J. Thomson, estava incorreto. Rutherford afirmou com seu experimento, que o átomo não era apenas uma esfera maciça de carga elétrica positiva incrustada com elétrons como dizia J. J. Thomson. Segundo Rutherford, o átomo teria na verdade um núcleo de carga elétrica positiva de tamanho muito pequeno em relação ao seu tamanho total, sendo que este núcleo, que conteria praticamente toda a massa do átomo, estaria sendo rodeado por elétrons de carga elétrica negativa, os quais descreveriam órbitas helicoidais em altas velocidades.
A falha do modelo de Rutherford é mostrada pela teoria do electromagnetismo, de que toda partícula com carga elétrica submetida a uma aceleração origina a emissão de uma onda electromagnética. O elétron em seu movimento orbital está submetido a uma aceleração centrípeta e, portanto, emitirá energia na forma de onda eletromagnética. Essa emissão, pelo Princípio da conservação da energia, faria com que o elétron perdesse energia cinética e potencial, caindo progressivamente sobre o núcleo, fato que não ocorre na prática. A falha foi corrigida pelo modelo atômico de Bohr, de seu aluno e colega de trabalho Niels Bohr, que dizia que considerava a ideia de um modelo atômico planetário bonita demais para estar errada. Assim, com o auxílio das descrições quânticas da radiação eletromagnética propostas por Albert Einstein e Max Planck, conseguiu completar a teoria de Rutherford, ficando assim conhecida como modelo átomico-molecular de Rutherford-Bohr.

Nenhum comentário:
Postar um comentário